Von Jörg Hacker

"Ich bin der schnelle schwarze Tod, ich überhol das schnelle Boot und auch den schnellen Reiter", so reimte man im Mittelalter, um die rasche Verbreitung von Infektionskrankheiten wie der Pest zu beschreiben.
Dennoch: Es dauerte im 14. Jahrhundert fünf Jahre, bis sich der "Schwarze Tod", wie die Pest damals genannt wurde, von der Krim über Marseille bis nach Skandinavien ausbreitete. Heute reisen Infektionserreger in weniger als einer Woche um den Erdball.
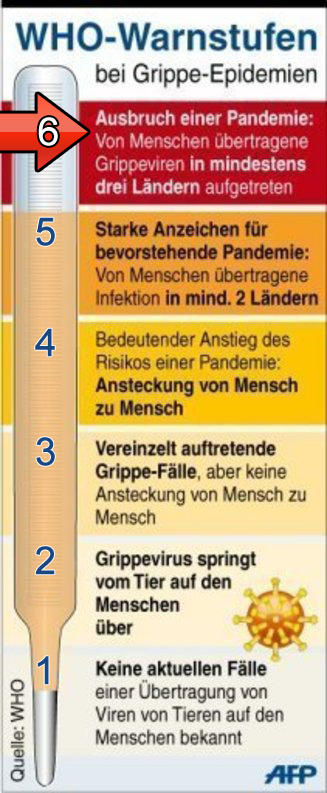
Der Versuch, den Erreger unter Kontrolle zu bringen: Die Arbeit an einem Impfstoff.Zu studieren ist dies bei der jetzt grassierenden "Neuen Grippe H1N1", die im Frühjahr dieses Jahres in Mexiko und den USA auftauchte, am 24. April global bekannt wurde, am 27. April in Europa und am 29. April in Deutschland ankam. Fünf Tage statt fünf Jahre braucht heute eine Pandemie.
Foto: Reuters
Aber nicht nur die Ausbreitung von Infektionen kann anhand der Neuen Grippe studiert werden. Sie stellt auch einen Modellfall für die evolutive Entwicklung von Krankheitserregern und deren Wirte dar - quasi "Evolution in nuce" und dies im Darwin-Jahr.
Die Darwinschen Prinzipien der Evolution - genetische Variabilität und darauf fußend Selektion und Ausbreitung, das "survival of the fittest" - gelten für die gesamte belebte Natur, selbstverständlich auch für Mikroben.
Die genetische Variabilität wird durch verschiedene Mechanismen wie Punktmutationen, Rekombination, Gentransfer und Genomreduktion sichergestellt. Die neuen Varianten sind dann in ihren Lebensräumen der Selektion unterworfen. Entscheidend ist letztlich, ob die Veränderung ihnen einen Vorteil bei der Ausbreitung bringt.
Ein interessantes, neues Beispiel für das Wirken der mikrobiellen Evolution sind die Infektionen, die durch das neue Influenzavirus H1N1 ausgelöst werden. Wichtig ist, dass im Fall von Infektionen immer zwei "Spieler" auftreten, der Infektionserreger und der Wirt, in diesem Fall das Neue Influenza-Virus H1N1 und der Mensch.
Das bewirkt eine enorme Beschleunigung der ansonsten trägen evolutionären Prozesse. Diese liefen und laufen zunächst langsam ab, die ersten Zellen sind wohl vor fast vier Milliarden Jahren entstanden. Der Mensch selbst ist ein echter "Newcomer" der Evolution, er erschien im Holozän, also vor etwa zwei Millionen Jahren - die Evolution braucht ihre Zeit, das wusste schon Darwin.
Aber dennoch - das was so langsam abläuft, die Entstehung und Anpassung neuer Arten und Formen, die der große Evolutionsbiologe Ernst Mayr als "Makroevolution" bezeichnete, hat seine Entsprechung in den schnellen Prozessen der "Mikroevolution", der Veränderung und Entwicklung von Organismen in extrem kurzen Zeiträumen - Stunden, Tagen, Wochen.
Die Veränderungen von Infektionserregern und ihren Wirten sind beispielgebende Vorgänge der Mikroevolution. Dies gilt auch und gerade für das aktuelle Geschehen der H1N1-Influenza-Welle.
Das ist kein Wunder, laufen doch die Prozesse in der Zelle, etwa die Verdopplung des genetischen Materials, der Nukleinsäuren DNS oder in Viren üblichen RNS, oder die Umsetzung der Erbinformation in Eiweißstrukturen in atemberaubenden Geschwindigkeiten ab - allein bei dem Umschreiben der DNS-Information in RNS sind 1400 Schritte in einer Sekunde zu beobachten - und das mit ungeheurer Präzision.
Aber die Natur macht Fehler - wenn man so will, sind diese Fehlerraten in die molekularen Lebensprozesse eingebaut, um Variabilität und damit Evolution möglich zu machen. So auch bei den Neuen H1N1-Varianten, deren Erbgut wie bei allen Influenza-Viren aus acht RNS-Segmenten besteht.
Diese "neuen" Viren haben sich bereits genetisch verändert, so unterscheidet sich das Oberflächenprotein Hämagglutinin (oder H1-Protein) des Erregers der Neuen Influenza stark vom H1-Protein der normalen saisonal wiederkehrende Grippeviren. Diese Mutationen haben eine große biologische Wirkung, im Falle des H1-Proteins führen sie zu einer Anpassung an den menschlichen Wirt.
Und weitere Mutationen können das Virus weiter verändern. So wird ein krankmachendes Eiweiß, PB1-E2, momentan von den H1N1-Viren nicht produziert, da es eine Mutation enthält, die zu einem Stopp seiner Produktion führt. Eine Rückmutation könnte nun aus dem "Stopp" ein "Go" machen, und das Virus hätte seine krankmachende Wirkung erhöht.
Ähnlich verhält es sich mit dem Eiweiß PB2, dessen Struktur noch immer stark an tierische Zellen angepasst ist, auch hier könnte eine Mutation dazu führen, dass es sich noch besser in menschlichen Zellen vermehrt, also pathogener wird. Das kann ein evolutionärer Vorteil für die Viren sein, indem sie mehr Kopien ihrer selbst erzeugen und nach den Darwinschen Gesetzen die Erbanlage für das neue Eiweiß stärker vererben können.
Und noch weitere Mutationen könnten große Wirkungen haben: Die neuen H1N1-Viren sind empfindlich gegen Medikamente der sogenannten Neuraminidase-Hemmer, zu denen Präparate wie Tamiflu oder Relenza zählen. Diese Arzneimittel blockieren das Oberflächeneiweiß Neuraminidase (N-Protein).
Mutationen in den N-spezifischen Genen könnten nun zu Resistenzen gegen diese Medikamente führen. Vereinzelt sind solche Mutationen in den vergangenen Wochen aufgetaucht, so dass nicht ausgeschlossen werden kann, dass H1N1 in der Zukunft zumindest gegen eines der derzeit wirksamen Medikamente resistent werden könnte.
Durch diese möglichen Mutationsereignisse könnten sich in der Zukunft also Viren entwickeln, die gefährlicher für den Menschen sind als die aktuell zirkulierende Variante.
Neben den erwähnten Mutationen verändern Infektionserreger ihr Genom auch durch Prozesse des Gentransfers und der Rekombination. Dies hat bei Influenza-Viren mit der Tatsache zu tun, dass auch zwei verschiedene Viren gleichzeitig eine menschliche oder tierische Zelle befallen können.
So eine Doppelinfektion kann dazu führen, dass sich einzelne Genabschnitte der beiden Genome neu arrangieren, man spricht von Rekombination. Auch können ganze Segmente ausgetauscht werden, dies wird Reassortment genannt. Wir wissen aus der Analyse der neuen H1N1-Genome, dass sie Virus-RNA enthalten, die zuvor bei Schweinen, Vögeln und Menschen isoliert wurden.
Auch Viren vergangener Epidemien oder Pandemien enthalten Erbmaterial, das für tierische, aber auch für menschliche Viren charakteristisch ist. Insgesamt gilt: Je heftiger das Infektionsgeschehen, um so größer die Chance, dass es zu neuen Virusvarianten kommt, welche stärkere krankmachenden Wirkungen und erhöhte Resistenzprofile aufweisen könnten.
Deshalb ist es sinnvoll, schon jetzt, obwohl die H1N1-Infektionen derzeit meist mild verlaufen, Maßnahmen zu ergreifen, um die Ausbreitung und damit die Evolutionsräume des Virus zu reduzieren.
Natürlich sind solche Mutationsprozesse nicht auf Influenza-Viren beschränkt, als universelle Evolutionsmechanismen werden sie bei praktisch allen Organismen gefunden, darunter bei vielen anderen Krankheitserregern wie dem Pestbazillus, den Cholerabakterien oder dem Aids-Virus.
Rekombination und Gentransfer stellen auch bei diesen Infektionserregern die Triebfedern der Evolution dar, von Antibiotika-resistenten Staphylokokken bis zu den Erregern von Hirnhautinfektionen, von pathogenen Pilzen bis hin zum Malaria-Erreger: die Evolutionsmechanismen wirken universell.
Es drängt sich die Frage auf, welche Rolle der Mensch als potentieller Wirt der Neuen H1N1-Viren in dem Geschehen spielt. Es sind viele Beispiele bekannt, in denen auch Wirtsorganismen ihre Gene im Rahmen des Infektionsgeschehens ändern und resistent werden können.
Dabei passt sich nicht das Immunsystem an, sondern es vererben sich resistent machende genetische Merkmale. Dies gilt unter anderem für Patienten mit Malaria, Aids oder Hirnhautentzündung, die Änderungen des Erbmaterials aufweisen, welche eine Resistenz gegen die genannten Infektionskrankheiten begründen.
Aber diese Prozesse brauchen ihre Zeit. Auch das Immunsystem reagiert mit der Produktion von Antikörpern oder anderen spezifischen Abwehrzellen, dies aber eben nur nach einer Infektion, die ja gerade verhindert werden soll. Haben wir die Zeit, auf diese Vorgänge, die die Evolution für die Wirtsanpassung bereithält, zu warten? Mit Sicherheit nicht - denn Geschwindigkeit zählt.
Uns geht es doch eher wie der Herzkönigin "Red Queen" aus Lewis Carrols Geschichte "Alice hinter den Spiegeln", die der neugierigen Alice erklärt: "Hierzulande musst du so schnell rennen, wie du kannst, wenn du am gleichen Fleck bleiben willst." Eine treffende Metapher für Infektionsbiologen.
"Schnell rennen" heißt, alles zu versuchen, um dem Erreger schon jetzt seine Chancen zur evolutiven Weiterentwicklung zu nehmen. Sei es durch die Anpassung des individuellen Verhaltens und durch seuchenhygienische Maßnahmen, sei es durch den Einsatz von Medikamenten oder durch die Entwicklung und Produktion von Impfstoffen. "Am selben Fleck bleiben" heißt in diesem Fall, Krankheit und Sterblichkeit zu minimieren.
Der Autor ist Präsident des in Deutschland für Seuchenprävention zuständigen Robert-Koch-Instituts.
Quelle: bild.de, rp-online.de, focus.de, welt.de, berlinonline.de, AFP, mz-web.de, n-tv.de, sueddeutsche.de, spiegel.de, aerztezeitung.de.....






0 Kommentare:
Kommentar veröffentlichen